¿Qué es la Ley DSCSA?
La Ley de Seguridad de la Cadena de Suministro de Medicamentos (DSCSA (Drug Supply Chain Security Act, por sus siglas en inglés)), de la FDA, promulgada el 27 de noviembre de 2013, exige que todos los dispensadores cumplan plenamente antes de la fecha límite del 27 de noviembre de 2024.
DSCSA es la ley que exige el seguimiento registrado de toda la cadena de suministro para evitar que entren en ella falsificaciones de medicamentos.
Comienza con el fabricante al dispensador y termina con el paciente.
¿Por qué se creó esta ley?
Esta ley federal fue creada para reemplazar las regulaciones a nivel estatal. El motivo principal de su creación es para retener la tendencia al alza de las proyecciones de la tasa de falsificación de medicamentos en los Estados Unidos.

¿Objetivo de Ley DSCSA?
El objetivo de la Ley DSCSA es la de proteger el producto y al paciente mediante lo siguiente: Aumentar la capacidad de ayudar y proteger a los consumidores de la exposición a medicamentos que puedan ser falsificados, robados, contaminados o dañinos de cualquier otra forma y mejorar la detección y eliminación de medicamentos potencialmente peligrosos de la cadena de suministro de medicamentos.
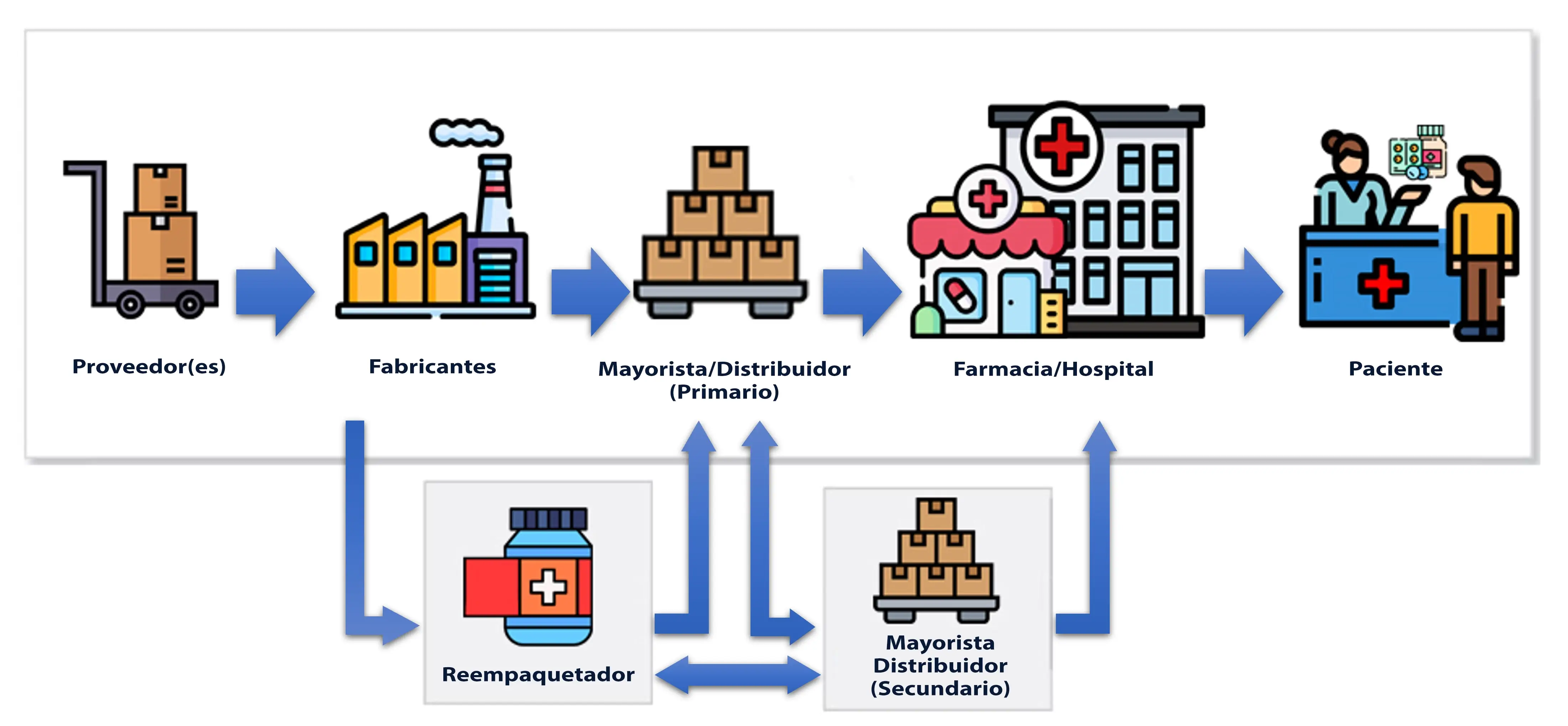
¿Quiénes son los "socios comerciales" de la ley DSCSA?
Proveedor(es).
Fabricantes.
Reempaquetadores.
Mayoristas/Distribuidores.
Proveedores de Logística Externos (3PL).
Dispensadores (Farmacia u Hospitales)
Farmacia minorista o hospitalaria.
Cadena de farmacias - No distribuyen al por mayor.
Autorizadas para dispensar/administrar medicamentos con prescripción.
NO se incluye la dispensación para uso en animales.
NO aplica a los médicos que utilizan medicinas RX en sus procedimientos de práctica privada.
Requisitos para el Cumplimiento de la ley DSCSA:
Estos son los seis requisitos establecidos en la Sección 582 (g) (1) por la FDA, para el cumplimiento de la ley DSCSA y que entrarán en vigor a partir del 27 de noviembre de 2023, para todos los dispensadores:
Los socios comerciales autorizados deben intercambiar información de transacciones (TI) y una declaración de transacciones (TS) de una manera segura, electrónica e interoperable.
TI debe incluir el identificador de producto (PI) a nivel de paquete para cada paquete incluido
Los socios comerciales autorizados deben tener sistemas y procesos para verificar los productos a nivel de paquete, incluido el SNI.
Los socios comerciales autorizados deben tener la sistemas y procesos para responder de inmediato con TI y TS por un producto a solicitud del secretario (u otro funcionario federal o estatal apropiado) en caso de un retiro del mercado o con el propósito de investigar un producto sospechoso o ilegítimo.
Los socios comerciales autorizados deben tener la sistemas y procesos necesarios para facilitar rápidamente la recopilación de la información necesaria para producir la TI para cada transacción que regrese al fabricante.
Cada persona que acepta una devolución vendible debe tener sistemas y procesos establecidos para permitir la aceptación del producto (s). Además, pueden aceptar devoluciones vendibles solo si pueden asociar los productos devueltos con sus TI y TS.
Glosario.
TI - Incluye el nombre del producto; su concentración y forma farmacéutica; su Código Nacional de Drogas; tamaño del contenedor y número de contenedores; numero de lote; Fecha de Transacción; fecha de envío; y el nombre y la dirección de las empresas de las que se transfiere la propiedad y a las que se transfiere la propiedad.
TS - Es una certificación de la empresa que transfiere la propiedad del producto de que ha cumplido con la DSCSA.
PI - Es un gráfico estandarizado que contiene el identificador numérico estandarizado (SNI) del producto, un número de lote y una fecha de vencimiento.
SNI - Comprende dos puntos de datos: el Código Nacional de Medicamentos y un número de serie alfanumérico único.
Preguntas y Respuestas:
En esta sección les mostraremos algunas de las preguntas más frecuentes realizadas a través de nuestro formularion de información.
-
¿Cuáles son los requisitos bajo DSCSA para los dispensadores farmacéuticos?
Los dispensadores farmacéuticos, como farmacias y hospitales, también deben verificar el identificador del producto y cierta otra información antes de dispensar medicamentos a los pacientes. También deben mantener registros de sus transacciones durante al menos seis años.
-
¿Cuáles son algunos de los elementos de datos que deben ser rastreados bajo DSCSA?
DSCSA requiere el rastreo de varios elementos de datos, incluyendo la identificación del producto (como el Código Nacional de Medicamentos), número de lote, fecha de caducidad, número de serie único, fechas de transacción y historial de transacciones.
-
¿Qué es la serialización de medicamentos bajo DSCSA?
Bajo DSCSA, la serialización de medicamentos se refiere a la asignación de un identificador único a cada paquete de medicamentos con receta. El identificador único consta de un identificador de producto, número de serie, número de lote y fecha de caducidad.
-
¿Quiénes deben cumplir con DSCSA?
Todos los socios comerciales involucrados en la distribución de medicamentos con receta deben cumplir con DSCSA, incluidos fabricantes, revendedores mayoristas y dispensadores.
-
¿Cuáles son las penalizaciones por incumplir con los requisitos de DSCSA?
Las penalizaciones por no cumplir con los requisitos de DSCSA pueden ser severas. Se pueden imponer multas y las empresas también pueden enfrentar el decomiso o la prohibición de venta de productos, así como procesamiento criminal.
-
¿Qué tengo que hacer con la información de la transacción?
Como cliente, usted está obligado a mantener la información durante seis años. El mantenimiento de registros le permitirá responder a las solicitudes en caso de retiros del mercado (product recall) o investigaciones relacionadas a producto sospechoso o ilegítimo.
Producto que soporta esta solución:
Les presentamos nuestro portafolio de soluciones diseñado para cubrir necesidades en el área de Cumplimiento de la Ley DSCSA, que les permitan implementar soluciones rápidas y especificas.


